Merit Medical HepaSphere Microspheres(With Doxorubicin) IFU-Int'l User Manual
Page 8
8
Pour un usage unique – contenu fourni stérile – Ne jamais réutiliser,
retraiter ou restériliser le contenu d'un flacon qui a été ouvert. La
réutilisation, le retraitement ou la restérilisation peuvent compromettre
l'intégrité structurelle du dispositif et/ou provoquer une défaillance de
celui-ci, ce qui à son tour peut entrainer une lésion, une maladie ou le
décès du patient. La réutilisation, le retraitement ou la restérilisation
risquent également de générer une contamination du dispositif et/ou
causer une infection ou infection croisée chez le patient, y compris
notamment, la transmission de maladie(s) infectieuse(s) d'un patient à
l'autre. La contamination du dispositif peut entrainer une lésion, une
maladie ou à le décès du patient. Toutes les procédures doivent être
réalisées selon la technique aseptique acceptée.
Les Microsphères HepaSphere NE DOIVENT PAS être utilisées
dans leur état sec d'origine. Elles doivent être reconstituées avant
l'emploi. Les Microsphères HepaSphere gonflent dans une solution
aqueuse. L'ampleur du gonflement dépend de la concentration ionique
de la solution. Les microsphères gonflent d'environ quatre fois leur
diamètre sec initial dans une solution aqueuse de NaCl 0,9 % et les
produits de contraste non ioniques. L'ampleur du gonflement quand elles
sont chargées en chlorhydrate de doxorubicine dépend de la quantité de
médicament avec laquelle le produit est chargé. Le chlorhydrate de
doxorubicine lyophilisé doit être reconstitué dans une solution de NaCl à
0,9 %. Les Microsphères HepaSphere subissent une légère diminution
de taille d'environ 20 % quand elles sont chargées en chlorhydrate de
doxorubicine par rapport à leur taille dans une solution aqueuse de NaCl
0,9 % pure. Les Microsphères HepaSphere sont compressibles et
peuvent être injectées facilement à travers des microcathéters.
Cependant, l'injection des Microsphères HepaSphere avant leur
expansion complète peut les empêcher d'atteindre la cible à emboliser
et provoquer l'embolisation d'une zone tissulaire plus étendue.
Note : La concentration maximale recommandée de chlorhydrate de
doxorubicine est de 5 mg/ml. Les concentrations de chlorhydrate de
doxorubicine supérieures à 5 mg/ml augmentent considérablement la
viscosité de la solution et rendent le maniement des Microsphères
HepaSphere difficile.
Les patients présentant des allergies connues aux produits de contraste
non ioniques peuvent nécessiter une administration de corticostéroïdes
avant l'embolisation. Des examens ou précautions supplémentaires
peuvent s'avérer nécessaires pour les soins péri opératoires pour les
patients atteints des affections suivantes :
• Diathèse hémorragique ou état d'hypercoagulabilité
• Immunodépression
COMPLICATIONS POTENTIELLES
L'embolisation vasculaire est une procédure à haut risque. Des
complications peuvent survenir à tout moment pendant ou après
l'intervention et peuvent inclure, mais ne se limitent pas à, ce qui suit :
• Une paralysie résultant d'une embolisation non ciblée ou d'une lésion
ischémique par œdème des tissus voisins
• Un reflux indésirable ou le passage des Microsphères HepaSphere
dans les artères saines voisines de la lésion visée ou après traversée de
la lésion, dans d'autres artères ou lits artériels, tels que la carotide
interne, la circulation pulmonaire, ou coronaire
• Une embolie pulmonaire par shunt artério-veineux
• Une ischémie à un endroit non souhaité, comprenant l'accident
vasculaire cérébral ischémique ou l’infarctus ischémique (y compris
l’infarctus du myocarde) et la nécrose tissulaire
• Une occlusion de lit capillaire et une lésion tissulaire
• Un vasospasme
• Une reperméabilisation
• la cécité, une perte auditive et la perte de l'odorat
• Les réactions à un corps étranger nécessitant des soins médicaux
• Une infection nécessitant des soins médicaux
• Des complications associées au cathétérisme (par exemple,
hématome au point de ponction, formation d'un caillot à l'extrémité du
cathéter et déplacement secondaire ou lésions nerveuses et/ou
vasculaires pouvant entrainer des troubles au niveau des membres
inférieurs)
• Une réaction allergique aux médications (par exemple, les
analgésiques)
• Une réaction allergique aux produits de contraste non ioniques ou aux
emboles
• La rupture d'un vaisseau ou de la lésion et hémorragie
• La mort
• Informations supplémentaires disponibles dans la section
Avertissements
COMPORTEMENT DE GONFLEMENT
Les Microsphères HepaSphere gonflent durant la reconstitution avec une
solution aqueuse de NaCl à 0,9 % et les produits de contraste non
ioniques. Quand elles sont hydratées dans 100 % d'une solution
aqueuse de NaCl à 0,9 % ou un produit de contraste non ionique, ou 50
% de produit de contraste non ionique et 50 % d'une solution aqueuse
de NaCl à 0,9 %, les Microsphères HepaSphere gonflent d'environ 4 fois
leur diamètre sec original en environ 10 minutes. Par exemple, des
Microsphères HepaSphere ayant un diamètre d'environ 50-100 microns
à l’état sec gonfleront jusqu'à environ 200-400 microns durant la
reconstitution telle que recommandée ci-dessous. Du fait de la variabilité
inhérente du processus de gonflement, quelques Microsphères
HepaSphere se trouveront légèrement en dehors de cette plage après la
reconstitution, de sorte que le médecin doit s'assurer de choisir
soigneusement la taille des Microsphères HepaSphere en fonction de la
taille des vaisseaux au niveau désiré d’occlusion dans le système
vasculaire et en fonction de la nature de la solution aqueuse.
Note : Pour gonfler correctement, les Microsphères HepaSphere doivent
être exposées à un minimum de 10 ml de solution. L'ampleur du
gonflement, quand il y a chargement en chlorhydrate de doxorubicine,
dépend de la quantité de médicament avec laquelle le produit est
chargé. Les Microsphères HepaSphere subissent une légère diminution
de taille d'environ 20 % quand elles sont chargées en chlorhydrate de
doxorubicine par rapport à leur taille dans une solution aqueuse de NaCl
à 0,9 % pure.
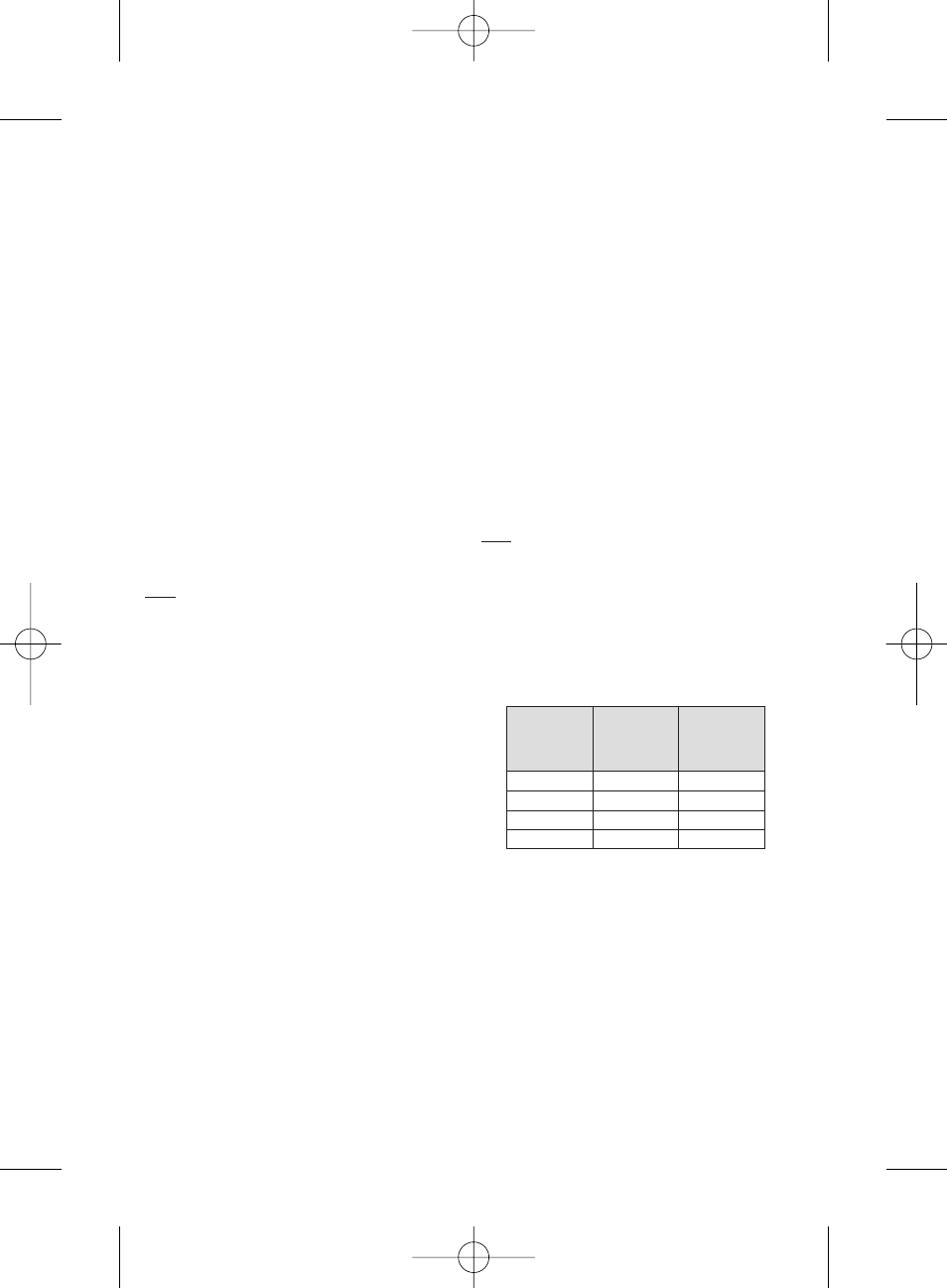
COMPATIBILITE AVEC LE CATHETER
Les Microsphères HepaSphere peuvent être injectées avec des
microcathéters ayant les spécifications suivantes :
INSTRUCTIONS
Les Microsphères HepaSphere doivent être reconstituées avec 100 %
d'une solution de NaCl à 0,9 % ou d'un produit de contraste non ionique,
ou avec 50 % de produit de contraste non ionique et 50 % d'une solution
aqueuse de NaCl à 0,9 %, en l’absence d’administration de chlorhydrate
de doxorubicine, ou chargées avec une solution de chlorhydrate de
doxorubicine avant le positionnement du cathéter.
• Choisir soigneusement la taille des Microsphères HepaSphere en
fonction de la taille des vaisseaux au niveau désiré de l'occlusion dans
le système vasculaire et en fonction de la nature de la solution aqueuse.
Voir la description « COMPORTEMENT DE GONFLEMENT ».
• Des Microsphères HepaSphere peuvent se trouver à l'extérieur du
flacon. Aussi, le flacon doit être manié de manière aseptique à l'écart du
champ stérile principal.
• S'assurer de la compatibilité des Microsphères HepaSphere avec le
diamètre du cathéter à utiliser. Voir le tableau ci-dessus.
• Inspecter l'emballage pour confirmer son intégrité. Retirer le flacon du
sachet. La surface externe du flacon est stérile.
Sec (µm)
Plage de taille
reconstituée
approximative
(
µm)
Diamètre interne
du cathéter
(pouces)
30-60
120 - 240
≥ 0.021
50-100
200 - 400
≥ 0.021
100-150
400 - 600
≥ 0.024
150-200
600 - 800
≥ 0.027
730095003_A ID 102412_IFU HS DOXO :print 9/11/12 17:07 Page 8
