Merit Medical HepaSphere Microspheres(With Doxorubicin) IFU-Int'l User Manual
Page 52
52
Flakon, kapak ya da po
şet hasar görmüşse kullanmayınız.
Yalnızca bir hastada kullanılmak içindir! - çindekiler steril olarak
kullanıma sunulmu
ştur - Asla tekrar kullanmayın, tekrar işleme tabi
tutmayın ya da açılmı
ş haldeki bir flakonun içindekileri tekrar sterilize
etmeyin. Flakonun tekrar kullanılması, tekrar i
şleme tabi tutulması ya
da tekrar sterilize edilmesi cihazın yapısal bütünlü
ğünü tehlikeye
atabilir ve/veya cihazın çalı
şmamasına yol açabilir ki bu gibi bir
durumda hasta yaralanabilir, hastalanabilir, hatta ölebilir. Flakonun
tekrar kullanılması, tekrar i
şleme tabi tutulması ya da tekrar sterilize
edilmesi ayrıca cihazın kirlenme riskinin ortaya çıkmasına yol açabilir
veya bir hastadan di
ğer bir hastaya enfeksiyöz bir hastalığın ya da
enfeksiyöz hastalıkların bula
şması dahil, ancak bununla sınırlı olmamak
üzere hastanın enfekte olmasına ya da çapraz enfeksiyona maruz
kalmasına neden olabilir. Cihazın kirlenmesi sonucunda hasta
yaralanabilir, hastalanabilir, hatta ölebilir. Bu nedenle, prosedürlerin
tamamı kabul edilen aseptik tekni
ğe göre gerçekleştirilmelidir.
HepaSphere
Mikroküreler,
orijinal
kuru
halindeyken
KULLANILMAMALIDIR.
HepaSphere Mikrokürelerin kullanılmaya
ba
şlamadan önce sulandırılması gerekmektedir. HepaSphere
Mikroküreler sulu çözeltide
şişer. Şişmenin boyutu çözeltinin iyonik
konsantrasyonuna ba
ğlıdır. Mikroküreler, ilk kuru haldeki çaplarına
kıyasla, %0,9 NaCl sulu çözelti ve iyonik olmayan kontrast madde içinde
çaplarının yakla
şık dört katına kadar şişebilir.Doksorubisin HCl ile yüklü
oldu
ğunda şişmenin boyutu,ürünün yüklenmiş olduğu ilacın miktarına
ba
ğlıdır. Liyofilize doksorubisin HCl, %0,9 NaCl çözeltisi içinde
sulandırılmalıdır. Saf %0,9 NaCl sulu çözeltisindeki büyüklü
ğü ile
kar
şılaştırıldığında,doksorubisin HCl ile yüklü olduklarında HepaSphere
Mikrokürelerin büyüklüklerinde yakla
şık %20 oranında az bir küçülme
meydana gelir. HepaSphere Mikroküreler sıkı
ştırılabilir özelliğe sahiptir
ve mikrokateterler yardımıyla kolayca enjekte edilebilir. Bununla
beraber, HepaSphere Mikrokürelerin tam olarak geni
şlemeden enjekte
edilmesi, istenilen embolizasyon hedefine ula
şmamasına ve
muhtemelen daha büyük bir doku alanın embolizasyonunun
ba
şarısızlıkla sonuçlanmasına yol açabilir.
Not: Doksorubisin HCl ile ilgili önerilen maksimum konsantrasyon 5
mg/ml'dir. 5 mg/ml’nin üzerindeki doksorubisin HCl konsantrasyonları
yava
ş yavaş çözeltinin viskozitesini arttırır ve HepaSphere Mikroküreler
ile birlikte kullanılmasını zorla
ştırabilir.
yonik olmayan kontrast maddelere bilinen alerjisi olan hastalara
embolizasyon öncesi kortikosteroidlerin verilmesi gerekebilir. Ancak
a
şağıda tanımlanan koşullarda olan hastalarda, peri-prosedürel
bakımın yapılması sırasında ek de
ğerlendirmelerin yapılması ya da
tedbirlerin alınması gerekebilir:
• Kanamalı diyatezli (bedensel zayıflı
ğı olan) ya da hiper-koagülatif
durumu olan hastalar
• Ba
ğışıklık yetersizliği olan hastalar
OLASI KOMPLİKASYONLAR:
Vasküler embolizasyon yüksek riski olan bir prosedürdür. Prosedür
sırasında herhangi bir zamanda ya da prosedürü takiben
komplikasyonlar meydana gelebilir. Söz konusu komplikasyonlar
a
şağıdakileri içerebilir, ancak bunlarla sınırlı değildir:
• Hedefini bulamamı
ş embolizasyondan ya da komşu dokunun
ödemine ba
ğlı olarak meydana gelen iskemik yaralanmadan
kaynaklanan felç
• stenmeyen reflü ya da HepaSphere Mikrokürelerin hedeflenen
lezyona kom
şu olan normal arterlere ya da lezyondan geçerek diğer
arterlere ya da dahili karotid arter, pulmoner ya da koroner dola
şım gibi
arter yataklarına geçmesi
• Arteriovenöz
şanta bağlı olarak pulmoner emboli
• skemik inme, iskemik enfarktüs (miyokard enfarktüs dahil) ve doku
nekrozu dahil olmak üzere istenmeyen yerde iskemi
• Kapiler yata
ğın tıkanması ve doku hasarı
• Vazospazm
• Rekanalizasyon
• Körlük, i
şitme kaybı ve koku alma kaybı
• Tıbbi müdahale gerektiren yabancı cisim reaksiyonları
• Tıbbi müdahale gerektiren enfeksiyon
• Kateterizasyona ba
ğlı komplikasyonlar (örneğin, giriş yerinde
hematom, kateterin ucunda pıhtı meydana gelmesi ve daha sonra
kateterin yerinden çıkması ve bacakta hasarla sonuçlanabilen sinir
ve/veya dola
şım hasarı)
• laçlara kar
şı alerjik reaksiyon (örneğin, analjeziklere karşı)
• yonik olmayan kontrast maddeye ya da embolik materyale kar
şı
meydana gelen alerjik reaksiyon
• Damar ya da lezyon yırtılması ve kanama
• Ölüm
• Uyarılar kısmında ek bilgi bulunmaktadır
ŞİŞME DAVRANIŞI:
HepaSphere Mikroküreler %0,9 NaCl sulu çözeltisiyle ve iyonik olmayan
kontrast maddeyle sulandırıldı
ğı sırada şişer. %100’lük %0,9 NaCl sulu
çözelti içinde ya da iyonik olmayan kontrast maddeyle ya da %50 iyonik
olmayan kontrast maddeyle ve %50’lik %0,9 NaCl sulu çözeltiyle
sulandırıldı
ğında, HepaSphere Mikroküreler yaklaşık 10 dakika içinde
orijinal kuru haldeki çaplarının yakla
şık 4 katı kadar şişebilir. Örneğin,
kuru haldeyken yakla
şık 50-100 mikron çapa sahip olan HepaSphere
Mikrokürelerin çapı a
şağıda önerildiği şekilde sulandırıldığı takdirde
yakla
şık 200-400 mikrona kadar genişleyebilir. Şişme prosesinin
do
ğasında olan farklılıktan dolayı, bazı HepaSphere Mikroküreler
sulandırma sonrasında bu aralı
ğın biraz dışında kalmış olabilir. Bu
nedenle hekim vaskülatürdeki tıkanmanın arzu edilen seviyedeki hedef
damarlara ve sulu çözeltinin yapısına göre HepaSphere Mikrokürelerin
büyüklü
ğünü dikkatle seçtiğinden emin olmalıdır.
Not: Do
ğru bir şekilde genişlemesi için HepaSphere Mikrokürelerin en
az 10 ml'lik bir çözeltiye maruz bırakılması gerekmektedir. Doksorubisin
HCl ile yüklendi
ğinde şişmenin büyüklüğü ürüne yüklenmiş olan ilacın
miktarına ba
ğlıdır. Saf %0,9 NaCl sulu çözeltideki büyüklüğüyle
kar
şılaştırıldığında doksorubisin HCl ile yüklendiğinde HepaSphere
Mikrokürelerin büyüklü
ğünde yaklaşık %20 oranında hafif bir oranda
azalma meydana geldi
ği görülür.
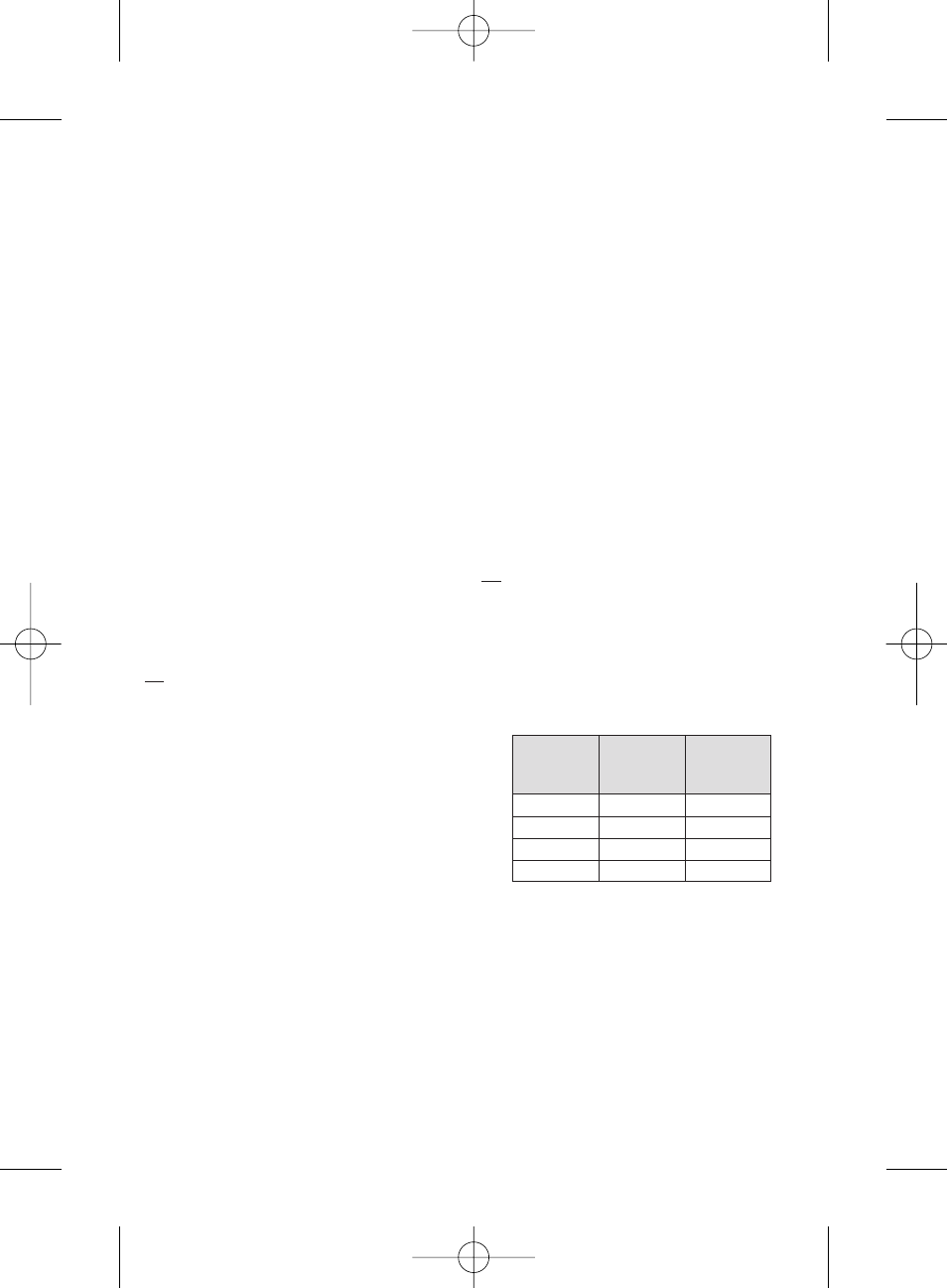
KATETERİN UYUMLULUĞU:
HepaSphere Mikroküreler a
şağıda yer alan spesifikasyonlara sahip olan
mikrokateterlerle enjekte edilebilir:
TAL MAT:
HepaSphere Mikrokürelerin %100’lük %0,9 NaCl sulu çözeltisiyle ya da
iyonik olmayan kontrast maddeyle ya da e
ğer doksorubisin HCl
uygulanmadan ya da kateterin konumlandırılması öncesinde
doksorubisin HCl çözeltisiyle yüklenmi
ş halde kullanılacaksa, %50’lik
%0,9 NaCl sulu çözeltiyle ve %50 iyonik olmayan kontrast maddeyle
sulandırılması gerekmektedir.
• Vaskülatürdeki istenilen oklüzyon seviyesindeki hedef damarların
büyüklü
ğüne göre HepaSphere Mikrokürelerin büyüklüğünü ve sulu
çözeltinin yapısını dikkatle seçin. "
Ş ŞME DAVRANIŞI" adlı bölümdeki
tanımlamaya bakınız.
• HepaSphere Mikroküreler flakonun dı
şında olabilir. Bu nedenle,
flakonun ana steril alanın dı
şında bir yerde aseptik koşullarda
kullanılması gerekir.
• Kullanılacak olan kateterin istenilen büyüklü
ğü ile HepaSphere
Kuru (µm)
Yakla
şık
Sulandırılmı
ş
Büyüklük Aralı
ğı
(
µm)
Kateter
Büyüklü
ğь
з Зap (inз)
30-60
120 - 240
≥ 0.021
50-100
200 - 400
≥ 0.021
100-150
400 - 600
≥ 0.024
150-200
600 - 800
≥ 0.027
730095003_A ID 102412_IFU HS DOXO :print 9/11/12 17:11 Page 52
