Merit Medical HepaSphere Microspheres(With Doxorubicin) IFU-Int'l User Manual
Page 20
Non usare se il flaconcino, la capsula o la busta dovessero apparire
danneggiati.
Da usare su un unico paziente – Contenuto fornito sterile - Non riutilizzare,
ritrattare o risterilizzare mai il contenuto di un flaconcino già aperto. Il
riutilizzo, il ritrattamento o la risterilizzazione potrebbero compromettere
l’integrità strutturale del prodotto e/o portare al deterioramento del prodotto,
con il conseguente rischio di lesioni, malattie o morte al paziente. Il riutilizzo,
il ritrattamento o la risterilizzazione potrebbero anche comportare un rischio
di contaminazione del prodotto e/o causare un’infezione o un’infezione
incrociata nel paziente compresa, a titolo esemplificativo e non esaustivo, la
trasmissione di malattie infettive da un paziente a un altro. La
contaminazione del prodotto può causare lesioni, malattia o morte del
paziente. Tutte le procedure devono essere realizzate secondo la tecnica
asettica prevista.
Le microsfere HepaSphere NON DEVONO essere usate nel loro stato
originale a secco. Prima devono essere ricostituite. Le microsfere
HepaSphere si gonfiano in una soluzione acquosa. L’entità dell’aumento di
volume delle microsfere dipende dalla concentrazione ionica della soluzione.
In una soluzione acquosa di NaCl allo 0,9% e in un mezzo di contrasto non
ionico, le microsfere aumentano di circa quattro volte il loro diametro
rispetto al diametro iniziale a secco. L’entità dell’aumento di volume delle
microsfere quando sono caricate con doxorubicina HCl dipende dal farmaco
e dalla quantità di farmaco con cui è caricato il prodotto. La doxorubicina HCl
liofilizzata deve essere ricostitutita con una soluzione di NaCl allo 0,9%. Le
microsfere HepaSphere subiscono una leggera diminuzione di dimensioni
pari a circa il 20% quando sono caricate con doxorubicina HCl rispetto alle
dimensioni che assumono in una soluzione acquosa pura di NaCl allo 0,9%.
Le microsfere HepaSphere sono comprimibili e possono essere iniettate
facilmente per mezzo di microcateteri. Tuttavia, l’iniezione di microsfere
HepaSphere, prima che queste si gonfino completamente, potrebbe non
raggiungere l’obiettivo di embolizzazione prefissato e portare a una possibile
embolizzazione di una zona di tessuto maggiore.
Nota: la concentrazione massima raccomandata di doxorubicina HCl è di 5
mg/ml. Concentrazioni di doxorubicina HCl superiori a 5 mg/ml aumentano
sostanzialmente la viscosità della soluzione e rendono difficile l’uso delle
microsfere HepaSphere.
I pazienti con allergie note al mezzo di contrasto non ionico potrebbero avere
bisogno di assumere corticosteroidi prima dell’embolizzazione.
Potrebbero essere necessarie valutazioni o precauzioni aggiuntive nella
gestione della cura periprocedurale dei pazienti che presentano le seguenti
condizioni:
• diatesi emorragica o stato ipercoagulativo
• sistema immunitario compromesso
POTENZIALI COMPLICANZE
L’embolizzazione vascolare è una procedura ad alto rischio. In qualsiasi
momento durante o dopo la procedura, possono verificarsi complicanze
comprese a titolo esemplificativo e non esaustivo le seguenti:
• paralisi risultante dall’embolizzazione non mirata o lesione ischemica
derivante da edema del tessuto adiacente;
• riflusso o passaggio indesiderato di microsfere HepaSphere nelle arterie
sane adiacenti alla lesione da trattare o attraverso la lesione in altre arterie
o letti arteriosi, come l’arteria carotidea interna, la circolazione polmonare o
coronarica;
• embolia polmonare dovuta a shunt arterovenosi;
• ischemia di una sede indesiderata, compreso attacco ischemico,
compreso l’infarto ischemico (compreso l’infarto del miocardio) e necrosi dei
tessuti;
• occlusione del letto capillare e danno tissutale;
• vasospasmo;
• ricanalizzazione;
• cecità, perdita dell’udito e perdita dell’olfatto;
• reazioni a corpo estraneo per cui sia necessario l’intervento di un medico;
• infezione per cui sia necessario l’intervento di un medico;
• complicanze correlate con il cateterismo (per esempio, ematoma nella
sede d’ingresso, formazione di coaguli sulla punta del catetere e
susseguente distacco, e lesioni nervose e/o circolatorie che possono
causare lesioni alle gambe);
• reazione allergica ai farmaci (per esempio, agli analgesici);
• reazione allergica al mezzo di contrasto non ionico o al materiale
embolico;
• rottura del vaso o della lesione ed emorragia;
• morte;
• ulteriori informazioni si trovano nella sezione Avvertenze.
COMPORTAMENTO DI GONFIAGGIO
Le microsfere HepaSphere si gonfiano durante la ricostituzione con una
soluzione acquosa di NaCl allo 0,9% e mezzo di contrasto non ionico.
Quando si idratano utilizzando al 100% una soluzione acquosa di NaCl allo
0,9% o un mezzo di contrasto non ionico, o utilizzando il 50% di mezzo di
contrasto non ionico e il 50% di soluzione acquosa di NaCl allo 0,9%, le
microsfere HepaSphere si gonfiano fino a raggiungere circa 4 volte il loro
diametro originale a secco in circa 10 minuti. Per esempio, le microsfere
HepaSphere che presentano un diametro di circa 50-100 micron nel loro
stato originario di disidratazione, aumenteranno di circa 200-400 micron
durante il tempo di ricostituzione raccomandato qui di seguito. A causa
dell’intrinseca variabilità del processo di gonfiaggio, alcune microsfere
HepaSphere saranno leggermente al di fuori di queste dimensioni dopo la
ricostituzione, quindi è importante che il medico selezioni accuratamente la
grandezza delle microsfere HepaSphere in base alle dimensioni dei vasi da
trattare nel livello desiderato di occlusione nel sistema vascolare e alla
natura della soluzione acquosa.
Nota: per far dilatare correttamente le microsfere HepaSphere è necessario
esporle a una soluzione di almeno 10 ml.
L’entità del gonfiaggio quando si caricano di doxorubicina HCl dipende dalla
quantità di farmaco con cui si carica il prodotto. Le microsfere HepaSphere
subiscono una leggera diminuzione pari a circa il 20% quando sono caricate
con doxorubicina HCl rispetto alle dimensioni che assumono in una
soluzione acquosa pura di NaCl allo 0,9%.
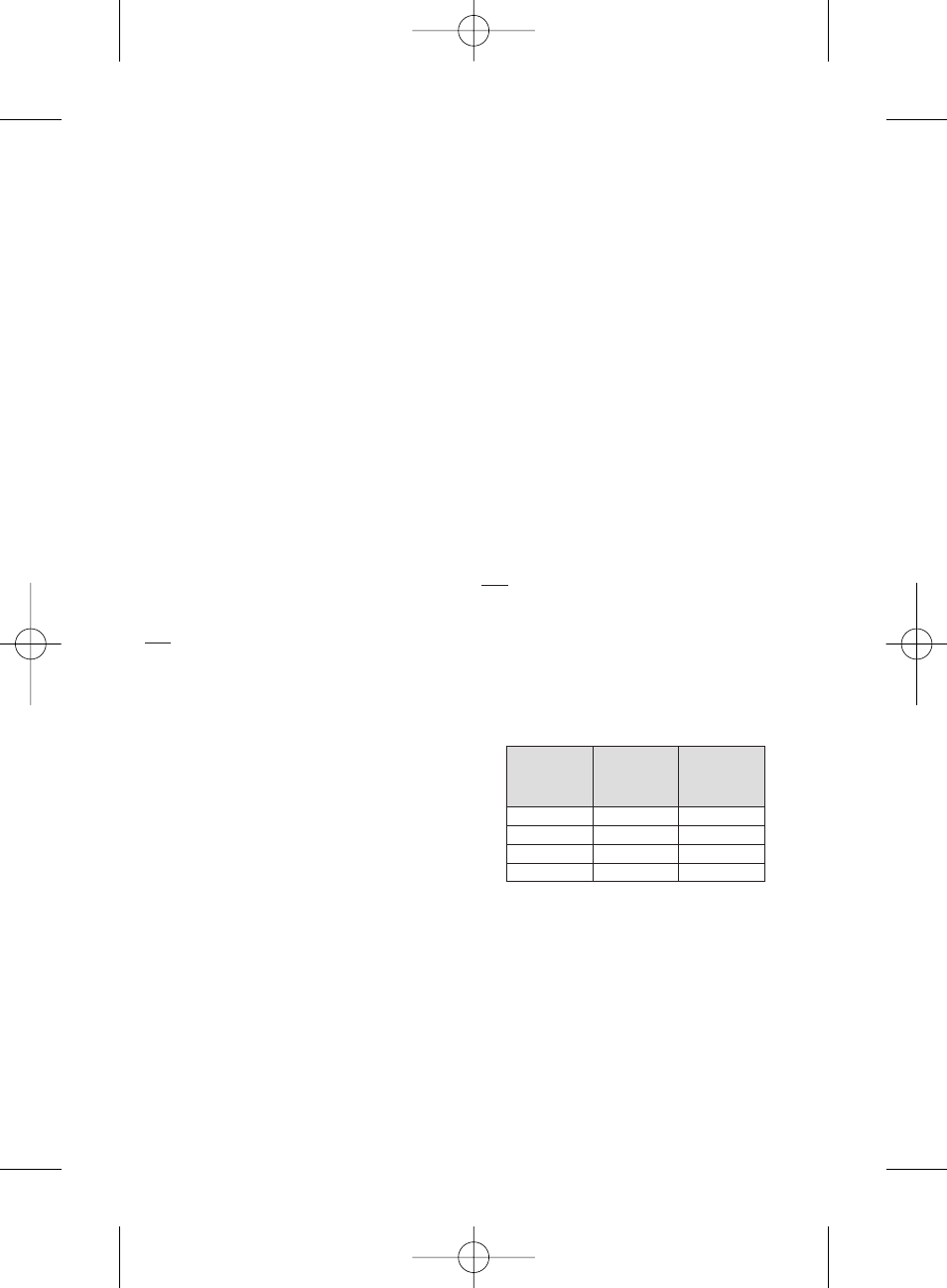
COMPATIBILITA’ DEL CATETERE
Le microsfere HepaSphere possono essere iniettate con microcateteri con
le caratteristiche riportate di seguito.
ISTRUZIONI
Le microsfere HepaSphere devono essere ricostituite utilizzando al 100%
una soluzione acquosa di NaCl allo 0,9% o un mezzo di contrasto non
ionico, o utilizzando il 50% di mezzo di contrasto non ionico e il 50% di
soluzione acquosa di NaCl allo 0,9% se si usano senza il rilascio di
doxorubicina HCl, o si caricano con una soluzione di doxorubicina HCl
prima di posizionare il catetere.
• Scegliere accuratamente le dimensioni delle microsfere HepaSphere a
seconda delle dimensioni dei vasi da sottoporre al trattamento nel livello
di occlusione desiderato nella vascolarizzazione e della soluzione acquosa.
Consultare il punto “COMPORTAMENTO DI GONFIAGGIO”.
• Le microsfere HepaSphere possono essere presenti fuori dal flaconcino.
Pertanto, il flaconcino deve essere maneggiato in modo asettico al di fuori
del campo sterile principale.
20
Dimensioni a
secco (
µm)
Dimensioni
approssimative
ricostituite (
µm)
Diametro interno
dimensioni
catetere (pollici)
30-60
120 -240
≥ 0.021
50-100
200 - 400
≥ 0.021
100-150
400 - 600
≥ 0.024
150-200
600 - 800
≥ 0.027
730095003_A ID 102412_IFU HS DOXO :print 9/11/12 17:08 Page 20
